Електролиза — принцип на действие, предназначение и приложение
Процеси на електролиза
 Електролизата е широко разпространена в металургията на цветните метали и в редица химически индустрии. Метали като алуминий, цинк, магнезий се получават главно чрез електролиза. Освен това електролизата се използва за рафиниране (пречистване) на мед, никел, олово, както и за производство на водород, кислород, хлор и редица други химикали.
Електролизата е широко разпространена в металургията на цветните метали и в редица химически индустрии. Метали като алуминий, цинк, магнезий се получават главно чрез електролиза. Освен това електролизата се използва за рафиниране (пречистване) на мед, никел, олово, както и за производство на водород, кислород, хлор и редица други химикали.
Същността на електролизата е отделянето на частици от веществото от електролита, когато постоянен ток преминава през електролитичната баня и тяхното отлагане върху електроди, потопени във ваната (електроекстракция) или при прехвърляне на вещества от един електрод през електролита към друг (електролитно рафиниране). И в двата случая целта на процесите е да се получат възможно най -чистите вещества, които не са замърсени с примеси.
За разлика електронна проводимост метали в електролити (разтвори на соли, киселини и основи във вода и в някои други разтворители, както и в разтопени съединения), се наблюдава йонна проводимост.
Електролитите са проводници от втори клас. В тези разтвори и стопилки се извършва електролитна дисоциация — разпадане на положително и отрицателно заредени йони.
Ако електроди, свързани към източник на електрическа енергия, се поставят в съд с електролит — електролизатор, тогава в него ще започне да тече йонния ток, а положително заредените йони — катиони ще се придвижват към катода (това са предимно метали и водород) , и отрицателно заредени йони — аниони (хлор, кислород) — към анода.
На анода анионите се отказват от заряда си и се превръщат в неутрални частици, които се утаяват върху електрода. При катода катионите вземат електрони от електрода и също се неутрализират, утаявайки се върху него, а газовете, отделяни по електродите под формата на мехурчета, се издигат нагоре.
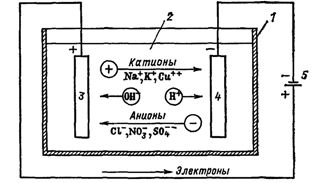
Ориз. 1. Процеси по време на електролиза. Електрична верига за баня: 1 — вана, 2 — електролит, 3 — анод, 4 — катод, 5 — захранване
Електрическият ток във външната верига е движението на електрони от анода към катода (фиг. 1). В този случай разтворът се изчерпва и за да се поддържа непрекъснатостта на процеса на електролиза, той трябва да бъде обогатен. Така се извършва извличането на определени вещества от електролита (електроекстракция).
 Ако анодът може да се разтвори в електролита, тъй като последният се изчерпва, тогава неговите частици, разтваряйки се в електролита, придобиват положителен заряд и се насочват към катода, върху който се отлагат, като по този начин прехвърлят материал от анода към катода. Тъй като процесът се извършва така, че примесите, съдържащи се в метала на анода, да не се прехвърлят към катода, този процес се нарича електролитно рафиниране.
Ако анодът може да се разтвори в електролита, тъй като последният се изчерпва, тогава неговите частици, разтваряйки се в електролита, придобиват положителен заряд и се насочват към катода, върху който се отлагат, като по този начин прехвърлят материал от анода към катода. Тъй като процесът се извършва така, че примесите, съдържащи се в метала на анода, да не се прехвърлят към катода, този процес се нарича електролитно рафиниране.
Ако електродът се постави в разтвор с йони на същото вещество, от което е направен, тогава при определен потенциал между електрода и разтвора нито електродът се разтваря, нито веществото се отлага върху него от разтвора.
Този потенциал се нарича нормален потенциал на веществото. Ако към електрода се приложи по -отрицателен потенциал, тогава отделянето на вещество (катоден процес) ще започне върху него, но ако е по -положително, тогава ще започне разтварянето му (аноден процес).
Стойността на нормалните потенциали зависи от концентрацията на йони и температурата. Общоприето е да се счита нормалният потенциал на водорода за нула. Таблица1 показва нормалните потенциали на електрода на някои водни разтвори на вещества при + 25 ° C.
Таблица 1. Нормални електродни потенциали при + 25 ° С

Ако електролитът съдържа йони от различни метали, тогава йони с по -нисък отрицателен нормален потенциал (мед, сребро, олово, никел) се отделят първо катода; алкалоземните метали са най -трудни за изолиране. Освен това във водните разтвори винаги има водородни йони, които ще се отделят по -рано от всички метали с отрицателен нормален потенциал, поради което по време на електролизата на последния значителна или дори по -голямата част от енергията се изразходва за отделянето на водород .
С помощта на специални мерки е възможно да се предотврати отделянето на водород в известни граници, но металите с нормален потенциал по -малък от 1 V (например магнезий, алуминий, алкалоземни метали) не могат да бъдат получени чрез електролиза от воден разтвор . Те се получават чрез разлагане на разтопените соли на тези метали.
Нормални електродни потенциали на вещества, посочени в табл. 1, са минимални, при които започва процесът на електролиза, на практика са необходими големи стойности на потенциала за развитието на процеса.
Разликата между действителния потенциал на електрод по време на електролиза и нормалния му потенциал се нарича свръхнапрежение. Той увеличава загубите на енергия по време на електролиза.
От друга страна, увеличаването на пренапрежението за водородни йони затруднява освобождаването му в катода, което прави възможно чрез електролиза от водни разтвори да се получат редица метали, които са по -отрицателни от водорода, като олово, калай, никел , кобалт, хром и дори цинк. Това се постига чрез провеждане на процеса при повишени плътности на тока върху електродите, както и чрез въвеждане на определени вещества в електролита.
Ходът на катодни и анодни реакции по време на електролиза се определя от следните два закона на Фарадей.
1. Маса на веществото мд, освободен по време на електролиза в катода или преминал от анода към електролита, е пропорционален на количеството електричество, преминало през електролита Азτ: мe = α/τ,тук a е електрохимичният еквивалент на веществото, g / C.
2. Масата на веществото, отделяно по време на електролиза със същото количество електричество, е правопропорционална на атомната маса на вещество А и обратно пропорционална на неговата валентност н: мNS = А / 96480н, тук 96480 е числото на Фарадей, C x mol-1.
По този начин електрохимичният еквивалент на вещество α= А / 96480н представлява масата на вещество в грамове, освободено от единица количество електричество, преминаващо през електролитичната баня — кулон (ампер -секунда).
За мед A = 63,54, н =2, α =63,54/96480-2= 0,000329 g / C, за никел α =0,000304 g / C, за цинк α=0,00034 g / C
 Всъщност масата на освободеното вещество винаги е по -малка от посочената, което се обяснява с редица странични процеси, протичащи във ваната (например отделяне на водород при катода), изтичане на ток и късо съединение между електродите .
Всъщност масата на освободеното вещество винаги е по -малка от посочената, което се обяснява с редица странични процеси, протичащи във ваната (например отделяне на водород при катода), изтичане на ток и късо съединение между електродите .
Съотношението на масата на действително освободеното вещество към неговата маса, което е трябвало да бъде освободено съгласно закона на Фарадей, се нарича текущ добив на веществото η1.
Следователно, за реален процес мNS = η1 NS (А / 96480н) NS То
Естествено, винаги η1
Ефективността на тока значително зависи от плътността на тока на електрода. С увеличаване на плътността на тока на електрода, ефективността на тока се увеличава и ефективността на процеса се увеличава.
Волтаж Uel, който трябва да бъде подаден към електролизера, се състои от: разлагащо напрежение Ep (потенциална разлика на анодната и катодната реакции), сумата от анодното и катодното пренапрежение, спада на напрежението в електролита Ep, спада на напрежението в електролита Ue = IRep (Rep — електролитно съпротивление), спад на напрежението в гумите, контактите, електродите Uc = Аз(Rw +Rдо +RNS). Получаваме: Uel = Ep + Ep + Ue + Uс.
Консумираната мощност по време на електролизата е равна на: Rel = IUимейл = Аз(Ep + Ep + Ue + Uс)
От тази мощност само първият компонент се изразходва за провеждане на реакции, останалите са топлинни загуби на процеса. Само по време на електролизата на разтопените соли част от топлината се отделя в електролита IUe, се използва полезно, тъй като се изразходва за топене на солите, заредени в електролизатора.
Ефективността на банята за електролиза може да бъде оценена чрез масата на веществото в грамове, освободена на 1 J консумирана електроенергия. Тази стойност се нарича енергиен добив на вещество.Може да се намери по израза qe = (αη1) /Uel100, тук α — електрохимичен еквивалент на вещество, g / C, η1 — токов изход, Uелектронна поща — напрежение на електролитна клетка, V.
