Какъв е потенциалът на електрода
Потенциалът на електрод или електроден потенциал на метал е потенциална разлика, която възниква на интерфейса метал-разтвор, когато метал е потопен в електролитен разтвор в резултат на взаимодействието на повърхностните метални йонни атоми, разположени в възлите на кристална решетка с полярни водни молекули, ориентирани към повърхността на електрода … Това се дължи на образуването на електрически двоен слой, тоест на асиметрично разпределение на заредените частици на границата.

Явлението разтваряне на метали в електролити се използва в химически източници на електричество. Метална плоча, опушена в разтвор на собствена сол, по един или друг начин, има тенденция да се разтваря в нея. Тази тенденция понякога се нарича еластичност на метала при разтваряне.
Цинкова плоча, потопена в разтвор на цинков сулфат ZnТАКА4, дава цинкови частици към разтвора под формата на положително заредени йони. Поради факта, че розовите атоми напускат под формата на положително заредени йони, върху цинковата плоча се образува излишък от свободни електрони и той се зарежда отрицателно, а излишък от положителни йони се образува в слоя течност близо до повърхността на цинка и следователно този слой е положително зареден. По този начин на границата между течността и метала възниква двоен електрически слой от пространствено разделени заряди с противоположен знак.
Тези заряди ще противодействат на по -нататъшното преминаване на метала в разтвор — отрицателните плочи задържат положителния метален йон, а положителният заряд на електролита изтласква металния йон обратно към плочата. С други думи, електрическото поле на двойния слой на границата метал-течност противодейства на по-нататъшния преход на метални йони в разтвор.Установява се равновесие между силите на склонността на метала да премине в разтвор, химически по природа, и електрическите сили, които им се противопоставят.
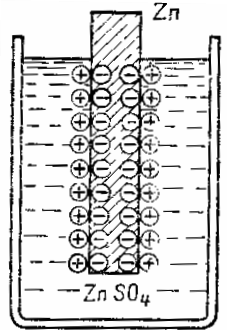
Диаграма на образуването на двоен електрически слой на границата между метал и електролит
По този начин, поради разтваряне в електролита, металният електрод придобива определен електрод (иначе електрохимичен) потенциал по отношение на електролита, който зависи от материала на електрода и състава на електролита.
Електродните потенциали обаче могат да бъдат положителни. Това се случва в случаите, когато положителните йони на разтвора преминават към електрода, зареждайки го положително, и слоя електролит — отрицателно, например, когато медна плоча е потопена в достатъчно концентриран разтвор на меден сулфат (CuSO)4).
Електрическият двоен слой може да се оприличи на кондензатор, едната от плочите на който е металната повърхност, а другата е слой от йони в разтвор на металната повърхност. Между противоположно заредените плочи и има разлика, или скок, потенциал.
Потенциалният скок на интерфейса електрод-разтвор може да служи като мярка за окислително-възстановителния капацитет на системата. Невъзможно е обаче да се измери такъв потенциален скок или, еквивалентно, потенциалната разлика между двете фази. Но можете да измерите e. и т.н. с. елементи, съставени от електродите, които ни интересуват, и някой един (един и същ във всички случаи) електрод, чийто потенциал условно се приема за нула.
Измерено е. и т.н. с.ще характеризира редокс капацитета на интересуващия ни електрод спрямо някаква условна нула. Получената по този начин стойност се нарича вътрешен потенциал на метала.
За да се измери потенциалът на електрода на всеки метал, е необходимо да се постави втори електрод в електролита, който от своя страна ще има определен потенциал на електрод, в зависимост от материала му. Следователно, само алгебричната сума от два електродни потенциала може да бъде измерена директно.
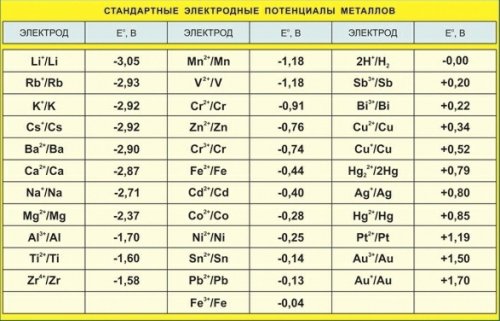
Поради тази причина потенциалите на електрода на различни материали се определят по отношение на стандарта (водороден електрод, чийто потенциал обикновено се приема за нула.
За измерване могат да се използват и други референтни електроди, чийто потенциал спрямо водородния стандартен електрод е известен. Този потенциал се открива и на базата на измерване на e. и т.н. с. верига, съставена от избран референтен електрод и стандартен водороден електрод.
Ако изследваният електрод, свързан със стандартен водороден електрод, е отрицателен, тогава знакът » -» се приписва на вътрешния потенциал, в противен случай — знака «+».
Например, потенциалът на електрода от цинк -0,76 V, мед +0,34 V, сребро +0,8 V, измерен по този начин в разтвор на съответната метална сол, се определя чрез изваждане на по -отрицателния потенциал от потенциала по -положителен.
Ако две метални плочи с различен електроден потенциал се поставят в съответния електролит, например в разтвор на сярна киселина (H2ТАКА4) поставени цинк (Zn) и мед (Cти), тогава волтметър, свързан към тези плочи, ще покаже напрежение между тях малко повече от 1 V.
Това напрежение, в случая наречено e. и т.н. с. галванична двойка, ще се дължи на разликата в електродните потенциали на медта, която има малък положителен потенциал, и цинка, който има значителен отрицателен потенциал. Такова устройство е най -простата галванична клетка — клетката Волта.
В галванична клетка химическата енергия се превръща в електрическа и с нейна помощ е възможно да се извършват електрически работи поради енергията на химична реакция.

Измерване на e. и т.н. с. галваничните клетки трябва да се произвеждат при липса на ток в клетъчната верига. В противен случай измереното e. и т.н. с. ще бъде по -малко от стойността, определена като разликата между равновесните потенциали на двата електрода… Всъщност определена концентрация на електрони върху електродите съответства на равновесния потенциал: колкото по -положителен е по -нисък, толкова по -отрицателен е по -висок. Съответно, структурата на тази част от двойния слой, която се намира в разтвора, също е различна.
Измерване на e. и т.н. с. клетка без токов поток обикновено се произвежда по компенсационния метод. За да го приложите, трябва да имате някои стандарт д. и т.н. с. Така нареченият нормален елемент служи като такъв стандарт. Най-често те използват живачно-кадмиевия нормален елемент на Weston, напр. и т.н. с. което е равно на 1.01830 V при 20 ° C.
