Електрически ток в електролити
Електрическият ток в електролитите винаги е свързан с пренасянето на материята. В металите и в полупроводниците например веществото, когато токът преминава през тях, не се пренася, тъй като в тези среди електроните и дупките са носители на ток, а в електролитите те се пренасят. Това е така, защото в електролитите положително и отрицателно заредените йони на веществото действат като носители на свободни заряди, а не изобщо електрони или дупки.
Разтопени много метални съединения, както и някои твърди вещества, принадлежат към електролити. Но основните представители на този тип проводници, които се използват широко в технологиите, са водни разтвори на неорганични киселини, основи и соли.

Веществото, когато електрически ток преминава през електролитната среда, се освобождава върху електродите. Това явление се нарича електролиза… Когато електрически ток преминава през електролита, положително и отрицателно заредените йони на веществото се движат едновременно в противоположни посоки.
Отрицателно заредените йони (аниони) се втурват към положителния електрод на източника на ток (анод), а положително заредените (катиони) — към отрицателния му полюс (катод).
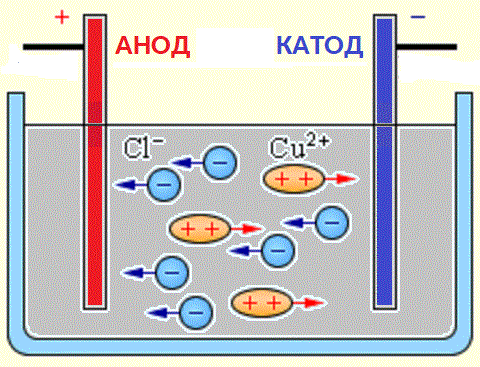
Източници на йони във водни разтвори на киселини, основи и соли са неутрални молекули, някои от които се разделят под действието на приложена електрическа сила. Това явление на разцепване на неутрални молекули се нарича електролитна дисоциация. Например, меден хлорид CuCl2 се разлага при дисоциация във воден разтвор на хлорни йони (отрицателно заредени) и мед (положително заредени).
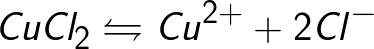
Когато електродите са свързани към източник на ток, електрическото поле започва да действа върху йони в разтвор или стопилка, докато хлорните аниони се придвижват към анода (положителен електрод), а медните катиони към катода (отрицателен електрод).
При достигане на отрицателния електрод положително заредените медни йони се неутрализират от излишъка от електрони на катода и стават неутрални атоми, които се отлагат върху катода. При достигане на положителния електрод, отрицателно заредените хлорни йони даряват по един електрон всеки по време на взаимодействието с положителния заряд на анода. В този случай образуваните неутрални хлорни атоми се комбинират по двойки, за да образуват молекули Cl2, а хлорът се отделя под формата на газови мехурчета на анода.
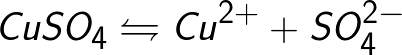
Често процесът на електролиза е придружен от взаимодействието на продуктите на дисоциация (това се нарича вторични реакции), когато продуктите на разпадане, освободени върху електродите, взаимодействат с разтворителя или директно с материала на електрода. Да вземем например електролизата на воден разтвор на меден сулфат (меден сулфат — CuSO4). В този пример електродите ще бъдат изработени от мед.
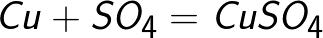
Молекулата на меден сулфат се дисоциира, за да образува положително зареден меден йон Cu + и отрицателно зареден сулфатен йон SO4-. Неутралните медни атоми се отлагат като твърд депозит върху катода. По този начин се добива химически чиста мед.
Сулфатният йон дарява два електрона на положителния електрод и се превръща в неутрален радикал SO4, който незабавно реагира с медния анод (вторична реакция на анода). Реакционният продукт на анода е меден сулфат, който преминава в разтвор.
Оказва се, че когато електрически ток преминава през воден разтвор на меден сулфат, медният анод просто постепенно се разтваря и медта се утаява върху катода.В този случай концентрацията на водния разтвор на меден сулфат не се променя.
През 1833 г. английският физик Майкъл Фарадей в хода на експерименталната работа установява закона за електролизата, който сега се нарича на негово име.
Законът на Фарадей ви позволява да определите количеството първични продукти, които се отделят върху електродите по време на електролиза. Законът гласи следното: «Масата m на веществото, отделяно върху електрода по време на електролиза, е правопропорционална на заряда Q, преминал през електролита.»
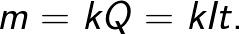
Коефициентът на пропорционалност k в тази формула се нарича електрохимичен еквивалент.
Масата на веществото, което се отделя върху електрода по време на електролиза, е равна на общата маса на всички йони, които са дошли на този електрод:
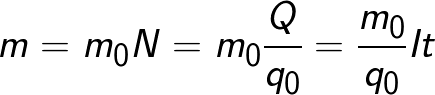
Формулата съдържа заряда q0 и масата m0 на един йон, както и заряда Q, преминал през електролита.N е броят на йони, дошли до електрода, когато зарядът Q преминава през електролита. Следователно отношението на масата на йона m0 към неговия заряд q0 се нарича електрохимичен еквивалент на k.
Тъй като зарядът на йон е числено равен на произведението на валентността на веществото и елементарния заряд, химическият еквивалент може да бъде представен в следната форма:
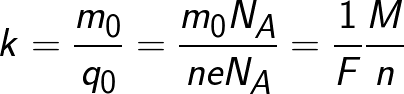
Където: Na е константата на Авогадро, M е моларната маса на веществото, F е константата на Фарадей.
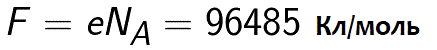
Всъщност константата на Фарадей може да се определи като количеството заряд, което трябва да премине през електролита, за да се освободи един мол едновалентно вещество върху електрода. Тогава законът на Фарадей за електролиза приема формата:
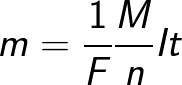
Явлението електролиза е широко използвано в съвременното производство. Например, алуминий, мед, водород, манганов диоксид и водороден пероксид се произвеждат в промишлеността чрез електролиза. Много метали се извличат от руди и се обработват чрез електролиза (електрорафиниране и електроекстракция).
Също така, благодарение на електролизата, химически източници на ток… Електролизата се използва при пречистване на отпадъчни води (електроекстракция, електрокоагулация, електрофлотация). Много вещества (метали, водород, хлор и др.) Се получават чрез електролиза за галванизация и галванизация.
Вижте също:Производство на водород чрез електролиза на вода — технология и оборудване
