Законите на електролизата на Фарадей
Законите на електролизата на Фарадей са количествени отношения, основани на електрохимичните изследвания на Майкъл Фарадей, които той публикува през 1836 г.
Тези закони определят връзката между количеството отделени вещества по време на електролиза и количеството електричество, преминало през електролита. Законите на Фарадей са два. В научната литература и в учебниците има различни формулировки на тези закони.
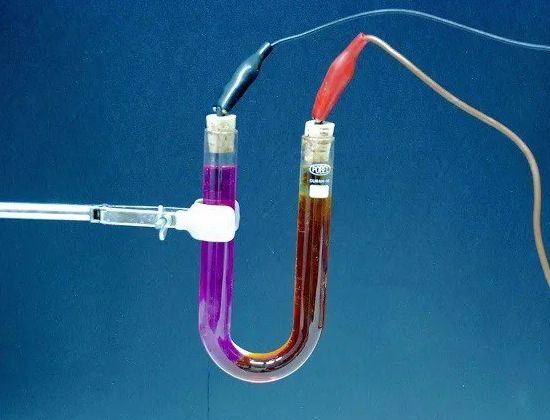
Електролиза — освобождаване от електролита на съставните му вещества по време на преминаването електрически ток… Например, когато електрически ток преминава през леко подкиселена вода, водата се разлага на съставните си части — газове (кислород и водород).
Количеството вещество, освободено от електролита, е пропорционално на количеството електричество, преминаващо през електролита, тоест произведението на силата на тока от времето, през което този ток тече. Следователно явлението електролиза може да служи за измерване на силата на тока и определяне единици ток.
Електролит — разтвор и като цяло сложна течност, която провежда електрически ток. В батериите електролитът е разтвор на сярна киселина (в олово) или разтвор на каустик калий или сода каустик (в желязо-никел). В галваничните клетки разтвори на всякакви химични съединения (амоняк, меден сулфат и др.) Също служат като електролит.

Майкъл Фарадей (1791 — 1867)
Майкъл Фарадей (1791 — 1867) — английски физик, основател на съвременната доктрина за електромагнитни явления. Започва трудовия си живот като чирак в работилница за подвързване на книги. Той получава само начално образование, но независимо изучава наука и работи като лаборант на химика Деви, той става велик учен, един от най -големите експериментални физици.
Фарардей се отвори явление на електромагнитна индукция, законите на електролизата, развиват учението за електрическите и магнитните полета и полагат основи на съвременните концепции за електромагнитното поле… Той беше първият учен, който имаше идеята за вибрационната, вълновата природа на електромагнитните явления.
Първият закон за електролизата на Фарадей
Масата на вещество, което ще се утаи върху електрод по време на електролиза, е правопропорционална на количеството електричество, прехвърлено към този електрод (преминало през електролита). Количеството електричество се отнася до количеството електрически заряд, което обикновено се измерва в висулки.
Вторият закон на електролизата на Фарадей
За определено количество електричество (електрически заряд), масата на химически елемент, който ще се утаи върху електрод по време на електролиза, е правопропорционална на еквивалентната маса на този елемент. Еквивалентната маса на веществото е неговата моларна маса, разделена на цяло число, в зависимост от химичната реакция, в която участва веществото.
Или
Едно и също количество електричество води до освобождаване на еквивалентни маси от различни вещества върху електродите по време на електролиза. За да се освободи един мол от еквивалента на всяко вещество, е необходимо да се изразходва същото количество електричество, а именно 96485 С. Тази електрохимична константа се нарича Номер на Фарадей.
Законите на Фарадей в математическа форма
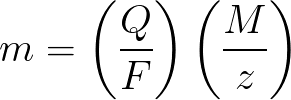
-
m е масата на веществото, отложено върху електрода;
-
Q е стойността на общия електрически заряд в висулките, преминал по време на електролиза;
-
F = 96485,33 (83) C / mol — число на Фарадей;
-
M е моларната маса на елемента в g / mol;
-
z — валентен брой йони на вещество (електрони на йон);
-
M / z — еквивалентна маса на веществото, нанесено върху електрода.
Приложено към първия закон на електролизата на Фарадей, M, F и z са константи, така че колкото повече Q е, толкова повече m ще бъде.
По отношение на втория закон на Фарадей за електролиза, Q, F и z са константи, така че колкото повече M / z, толкова повече m ще бъде.
За постоянен ток имаме
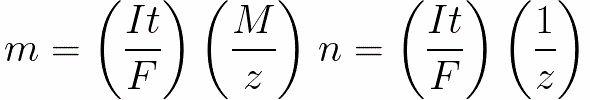
-
n е броят молове (количество вещество), освободени върху електрода: n = m / M.
-
t е времето на преминаване на постоянен ток през електролита. За променлив ток общият заряд се сумира по време на.
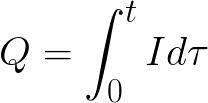
-
t е общото време на електролиза.
Пример за прилагане на законите на Фарадей
Необходимо е да се запише уравнението на електрохимичните процеси при катода и анода по време на електролизата на воден разтвор на натриев сулфат с инертен анод. Решението на проблема ще бъде следното. В разтвор натриевият сулфат ще се дисоциира по следната схема:
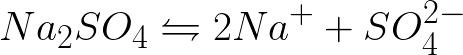
Стандартният потенциал на електрода в тази система е следният:
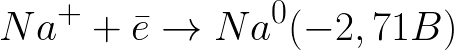
Това е много по-отрицателно потенциално ниво, отколкото за водороден електрод в неутрална среда (-0,41 V). Следователно, върху отрицателния електрод (катод), електрохимичната дисоциация на водата ще започне с отделянето на водород и хидроксиден йон съгласно следната схема:
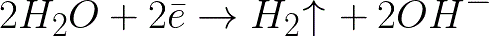
И положително заредените натриеви йони, приближаващи се към отрицателно заредения катод, ще се натрупват близо до катода, в съседната част на разтвора.
Електрохимичното окисляване на водата ще настъпи върху положителния електрод (анод), което ще доведе до отделяне на кислород, съгласно следната схема:
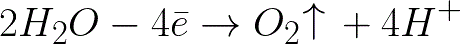
В тази система стандартният потенциал на електрода е +1,23 V, което е доста под стандартния потенциал на електрода, открит в следната система:
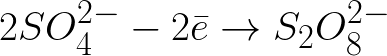
Отрицателно заредените сулфатни йони, движещи се към положително заредения анод, ще се натрупват в пространството близо до анода.
