Как работят и работят батериите
 В най -широкия смисъл на думата в технологията терминът „батерия“ се отнася до устройство, което позволява при някои условия на работа да акумулира определен вид енергия, а при други — да я изразходва за човешки нужди.
В най -широкия смисъл на думата в технологията терминът „батерия“ се отнася до устройство, което позволява при някои условия на работа да акумулира определен вид енергия, а при други — да я изразходва за човешки нужди.
Те се използват там, където е необходимо да се събира енергия за определено време и след това да се използва за извършване на големи трудоемки процеси. Например, хидравличните акумулатори, използвани в шлюзовете, позволяват на корабите да се издигат на ново ниво на коритото на реката.
Електрическите батерии работят с електричество по същия принцип: първо, те акумулират (акумулират) електричество от външен източник на зареждане и след това го дават на свързаните потребители, за да свършат работа. По своята същност те принадлежат към химически източници на ток, способни да извършват периодични цикли на разреждане и зареждане многократно.
По време на работа непрекъснато протичат химични реакции между компонентите на плочите на електрода с пълнещото им вещество — електролит.
Схематична диаграма на батерийно устройство може да бъде представена с опростен чертеж, когато две плочи от различни метали с проводници са вмъкнати в тялото на съда, за да осигурят електрически контакти. Между плочите се излива електролит.
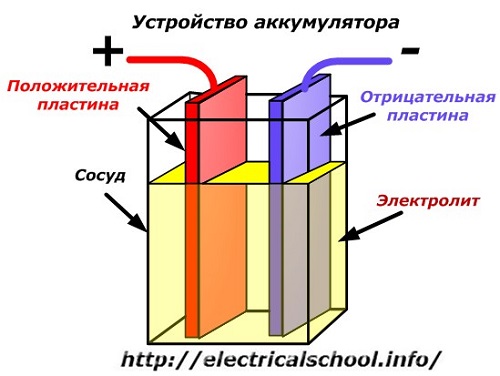
Работа на батерията при разреждане
Когато към електродите е свързан товар, например крушка, се създава затворена електрическа верига, през която протича разрядният ток. Образува се от движението на електрони в метални части и аниони с катиони в електролита.
Този процес е условно показан на диаграма с дизайн на никел-кадмиев електрод.
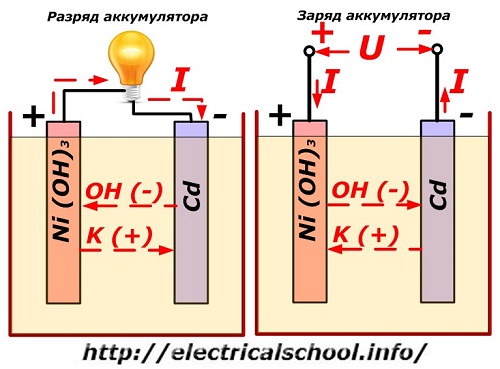
Тук като материал на положителния електрод се използват никелови оксиди с добавки от графит, които повишават електрическата проводимост. Металът на отрицателния електрод е гъбест кадмий.
По време на изхвърлянето частиците активен кислород от никелови оксиди се освобождават в електролита и се насочват към отрицателните плочи, където кадмият се окислява.
Работа на батерията при зареждане
Когато товарът е изключен, постоянно (в определени ситуации, пулсиращо) напрежение се подава към клемите на плочите с по -голяма стойност от тази на заредена батерия със същата полярност, когато плюс и минус клемите на източника и потребителя съвпада.
Зарядното устройство винаги има по -голяма мощност, което «потиска» остатъчната енергия в батерията и създава електрически ток в обратна посока на разреждането. В резултат на това вътрешните химични процеси между електродите и електролита се променят. Например, върху кутия с никел-кадмиеви плочи, положителният електрод е обогатен с кислород, а отрицателният-до състояние на чист кадмий.
Когато батерията се разрежда и зарежда, химичният състав на материала на плочите (електродите) се променя, но електролитът не се променя.
Методи за свързване на батерията
Паралелна връзка
Количеството на разрядния ток, което човек може да издържи, зависи от много фактори, но преди всичко от дизайна, използваните материали и техните размери. Колкото по -голяма е площта на плочите при електродите, толкова по -голям ток могат да издържат.
Този принцип се използва за паралелно свързване на клетки от същия тип в батерии, когато е необходимо да се увеличи тока към товара.Но за зареждане на такъв дизайн ще е необходимо да се повиши силата на източника. Този метод рядко се използва за готови конструкции, тъй като сега е много по-лесно веднага да закупите необходимата батерия. Но производителите на киселинни батерии го използват, свързвайки различни плочи в единични блокове.
Серийна връзка
В зависимост от използваните материали, напрежението от 1,2 / 1,5 или 2,0 волта може да бъде генерирано между двете електродни плочи на батерии, обичайни в ежедневието. (Всъщност този диапазон е много по -широк.) Очевидно не е достатъчен за много електрически устройства. Следователно батерии от същия тип са свързани последователно и това често се прави в един случай.
Пример за такъв дизайн е широко разпространената автомобилна разработка на базата на сярна киселина и плочи от оловни електроди.
Обикновено сред хората, особено сред шофьорите на транспорт, е обичайно да се нарича всяко устройство батерия, независимо от броя на съставните му елементи — кутии. Това обаче не е напълно правилно. Конструкцията, сглобена от няколко последователно свързани кутии, вече е батерия, за която съкратеното име е залепено «АКБ»… Вътрешната му структура е показана на фигурата.
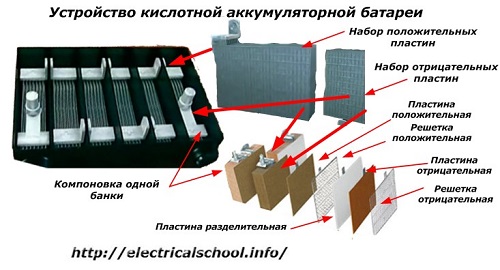
Всеки от бурканите се състои от два блока с набор от плочи за положителните и отрицателните електроди. Блоковете се вписват един в друг без метален контакт с възможност за надеждна галванична връзка през електролита.
В този случай контактните плочи имат допълнителна решетка и са отделени една от друга чрез разделителна плоча — сепаратор.
Свързването на плочите в блокове увеличава тяхната работна площ, намалява общото съпротивление на цялата конструкция и ви позволява да увеличите мощността на свързания товар.
От външната страна на кутията такава батерия има елементите, показани на фигурата по -долу.
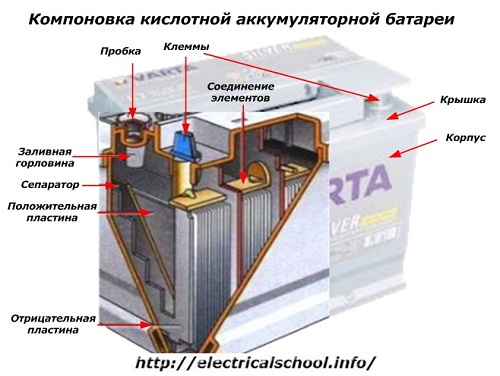
От него се вижда, че здравият пластмасов корпус е запечатан с капак и отгоре е оборудван с два извода (обикновено с форма на конус) за свързване към електрическата верига на автомобила. Маркировките за полярност са щамповани на техните клеми: «+» и «-«. Обикновено положителният извод има малко по -голям диаметър от отрицателния, за да блокира грешките в окабеляването.
Обслужваните батерии имат пълнителен отвор отгоре на всеки буркан, за да контролират нивото на електролита или да добавят дестилирана вода по време на работа. В него се завинтва щепсел, който предпазва вътрешните кухини на кутията от замърсяване и в същото време не позволява изливането на електролит при накланяне на батерията.
Тъй като при мощен заряд е възможно насилствено отделяне на газове от електролита (и този процес е възможен при интензивно шофиране), в тапите се правят дупки, за да се предотврати увеличаването на налягането вътре в кутията. Кислородът и водородът, както и електролитните пари излизат през тях. Препоръчително е да се избягват такива ситуации, свързани с прекомерни зарядни токове.
Същата фигура показва връзката на елементите между бреговете и разположението на електродните плочи.
Автомобилните стартерни акумулатори (оловна киселина) работят на принципа на двойна сулфатизация. По време на разреждането / зареждането върху тях протича електрохимичен процес, придружен от промяна в химичния състав на активната маса на електродите с отделяне / абсорбиране на вода в електролита (сярна киселина).
Това обяснява увеличаването на специфичното тегло на електролита при зареждане и намаляването при разреждане на батерията. С други думи, стойността на плътността ви позволява да оцените електрическото състояние на батерията. За измерването му се използва специално устройство — автомобилен ареометър.
Дестилираната вода, която е част от електролита на киселинните батерии, се превръща в твърдо състояние — лед при отрицателни температури.Следователно, за да се предотврати замръзване на акумулаторите на автомобили в студено време, е необходимо да се прилагат специални мерки, предвидени в правилата за експлоатация.
Какви видове батерии има
Съвременното производство за различни цели произвежда повече от три дузини продукти с различен състав на електроди и електролит. 12 известни модела работят само на базата на литий.

Като метал на електродите може да се намери следното:
-
водя;
-
желязо;
-
литий;
-
титан;
-
кобалт;
-
кадмий;
-
никел;
-
цинк;
-
сребро;
-
ванадий;
-
алуминий
-
някои други артикули.
Те влияят върху характеристиките на електрическия изход и следователно върху приложението.
Способността да издържат на краткотрайни големи натоварвания, произтичащи от въртенето на коляновите валове на двигатели с вътрешно горене от електрически стартерни двигатели, е характерна за оловно-киселинните батерии. Те се използват широко в транспорта, източници на непрекъсваемо захранване и системи за аварийно захранване.
Стандартен галванични клетки (обикновени батерии) обикновено се заменят с никел-кадмиеви, никел-цинкови и никел-метални хидридни батерии.
Но литиево-йонните или литиево-полимерните конструкции работят надеждно в мобилни и компютърни устройства, строителни инструменти и дори електрически превозни средства.
По вида на използвания електролит батериите са:
-
кисела;
-
алкални.
Има класификация на батериите по предназначение. Например в съвременните условия се появиха устройства, които се използват за пренос на енергия — презареждане на други източници. Т.нар външна батерия помага на собствениците на много мобилни устройства при липса на променлива електрическа мрежа. Той е в състояние да зарежда многократно таблет, смартфон, мобилен телефон.
Всички тези батерии имат същия принцип на действие и подобно устройство. Например, литиево-йонният модел на пръстите, показан на фигурата по-долу, в много отношения повтаря дизайна на разглежданите по-рано киселинни батерии.
Тук виждаме същите контактни електроди, плочи, сепаратор и корпус. Само те са направени, като се вземат предвид други условия на труд.
Основни електрически характеристики на батерията
Работата на устройството се влияе от параметрите:
-
капацитет;
-
енергийна плътност;
-
саморазреждане;
-
температурен режим.
Капацитет се нарича максимален заряд на батерията, който тя е в състояние да даде по време на разреждането до най -ниското напрежение. Изразява се в висулки (система SI) и ампер часове (единица извън системата).
Като вид капацитет има «енергиен капацитет», който определя енергията, отделяна по време на разреждането до минимално допустимото напрежение. Измерва се в джаули (SI) и ват-часове (не-SI единици).
Плътност на енергията изразено като съотношение на количеството енергия към теглото или обема на батерията.
Саморазреждане помислете за загуба на капацитет след зареждане при липса на натоварване на терминалите. Това зависи от дизайна и се усилва от нарушения на изолацията между електродите по много причини.
Работна температура засяга електрическите свойства и в случай на сериозни отклонения от нормата, посочена от производителя, може да повреди батерията. Топлината и студът са неприемливи, те влияят върху протичането на химичните реакции и налягането на средата вътре в кутията.
